随着DNA测序技术的发展,精准医学取得了巨大的进步。科学家们现在对癌症的分子基础有了越来越深的理解,病发于不同部位的多种癌症,如果带有相同的遗传变异,可以采用“不限癌种”的抗癌药精确地靶向治疗。
近期,《细胞》子刊Cell Metabolism上刊登的一项新研究,找到了一个在多种癌症中普遍存在的新靶点。研究人员发现,有一种酶是癌细胞基因异常和代谢异常的“结合点”,对肿瘤的生长起到重要作用。在多种癌症小鼠中,减少这种酶,可以遏制肿瘤生长,提高存活率。

这项研究由加州大学圣地亚哥分校Ludwig癌症研究所的Paul Mischel教授主导,与Scripps研究所Benjamin Cravatt教授的团队合作开展。
Mischel教授长期关注多发性胶质母细胞瘤(GBM)。这是大脑中最常见的恶性肿瘤,也是侵略性最强的脑瘤,通常会在患者确诊后15个月内夺去他们的生命。在这种难治癌症中,编码表皮生长因子受体(EGFR)的基因常会发生功能突变或过度表达,把EGFR变成一种“致癌受体”,发送信号驱动细胞无限制增殖,促进肿瘤形成。

▲本研究的通讯作者Paul S。 Mischel教授(图片来源:UCSD Ludwig癌症研究所)
在EGFR基因异常的GBM细胞中,研究者注意到,构成细胞质膜的磷脂成分发生了变化。这种变化让致癌受体可以更稳定地待在质膜上,传递和放大生长信号。
而在磷脂成分的变化过程中,研究人员发现,一种叫作LPCAT1(溶血磷脂酰胆碱酰基转移酶)的蛋白酶非常关键,起着重塑质膜结构的作用。

▲LPCAT1将溶血磷脂酰胆碱(LPC)转变为饱和磷脂酰胆碱(PC)(图片来源:参考资料[1])
进一步检测LPCAT1的蛋白水平和mRNA水平,这种酶确实在GBM患者的癌细胞中有着异常的高表达。
而在体外培养环境下,当研究人员通过shRNA抑制这种酶的表达,定位在细胞质膜上的致癌受体随之减少,生长因子信号传导被阻断,GBM癌细胞系的生长得到抑制。这些结果都提示,LPCAT1对于癌细胞来说是一种重要的酶。
那么抑制LPCAT1,是不是可以有助于遏制EGFR依赖的恶性肿瘤生长?研究人员首先在GBM小鼠模型中检验了这种治疗思路。当注射到体内的癌细胞在小鼠身上形成一定大小的肿瘤后,通过RNA干扰下调LPCAT1的表达,果然看到肿瘤的生长显著减缓,小鼠的总生存期则明显提高。
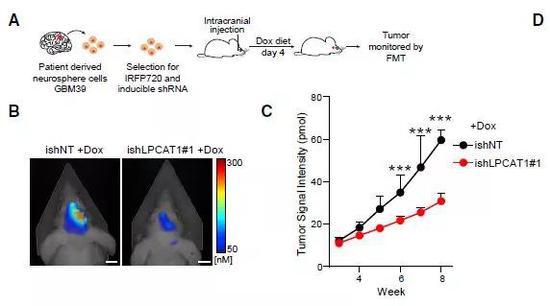
▲在GBM小鼠模型中,下调LPCAT1后,肿瘤生长受到抑制(图片来源:参考资料[1])
鉴于异常的生长因子受体信号通路还不止是发生在GBM一种恶性肿瘤中,LPCAT1酶很有可能在多种癌症类型中发挥重要作用。
研究人员分析临床样本和癌细胞系的测序数据库发现,在肺癌、卵巢癌、膀胱癌和侵袭性乳腺癌等多种恶性肿瘤中,超过30%的患者有LPCAT1基因拷贝数增加的现象。不仅如此,在包括肾癌、肝癌、宫颈癌和黑色素瘤等多种肿瘤中,LPCAT1表达升高还和患者总生存率降低有对应关系。

▲在包含1万多例患者的数据库,30多种癌症类型的样本中发现了LPCAT1与生长因子通路基因的基因组变化(图片来源:参考资料[1])
通过下调LPCAT1的表达来治疗与LPCAT1拷贝数增加有关的癌症,这一思路也在小鼠的侵袭性肺癌和肾癌的模型中得到了检验。利用shRNA在小鼠体内减少LPCAT1酶后,肿瘤细胞出现明显的死亡迹象,肿瘤生长得到了抑制。

▲本研究示意图(图片来源:参考资料[1])
“研究结果表明,LPCAT1是一种重要的酶,在癌症中失调,它将肿瘤中的常见基因变化和代谢变化串联了起来,进而推动肿瘤的侵袭性生长。”研究作者在论文中总结。
“迄今为止,还有很多患者未能从癌症的精准治疗中获益,这驱使我们更加深入地研究基因变化如何改变癌细胞的行为方式,从而解锁更有效的治疗方法。”Mischel教授说。
我们期待动物实验的结果后续能在人类患者中能到验证,通过这一富有潜力的新靶点为更多患者带来新的疗法。
 站长资讯网
站长资讯网